Воля и самоконтроль. Как гены и мозг мешают нам бороться с соблазнами
Последствия пренатального стресса зависят от генов младенца
Выходит, если по каким-то причинам, часто не зависящим от будущей мамы, во время беременности она нервничает, у ребенка обязательно будут проблемы с самоконтролем? Похоже, что нет: как мы обсуждали выше, самоконтроль – сложный признак, который определяется как влиянием среды, так и генами. Из-за того что взаимодействия генотипа и среды, они же GxE, очень запутанны, однозначно прогнозировать, как тот или иной фактор повлияет на силу воли ребенка, невозможно или, по крайней мере, очень сложно. Да, сам по себе пренатальный стресс – предиктор того, что с силой воли могут быть проблемы. Но не все люди, родившиеся у нервных матерей, не в состоянии укротить свои порывы, а среди тех, кому это удается плохо, есть просто несдержанные в желаниях, а есть те, кто попадает в тяжелые зависимости – от алкоголя, наркотиков, игр или сладкого. Ученые неоднократно пытались выяснить, какая смесь факторов среды и генотипа окажется наиболее гремучей, и первым делом проверили те самые "плохие" варианты генов, о которых мы говорили в главе 4. В число подозреваемых, разумеется, попал ген SLC6A4, кодирующий серотониновый траспортер 5-HTT. Напомню, что при помощи этого белка организм регулирует, как долго будет действовать серотонин, возвращая молекулы нейромедиатора обратно в нейроны, которые его выделили. В гене SLC6A4 есть область 5-HTTLPR, состоящая из повторяющихся участков ДНК, и если таких повторов недостаточно, транспортера синтезируется меньше, чем положено. Мозг людей с одной или двумя укороченными версиями SLC6A4 постоянно недополучает серотонин, так как имеющиеся белки-транспортеры попросту не справляются с тем, чтобы вовремя вернуть все выброшенные молекулы для повторного использования.
В 2010 году ученые из Университета Британской Колумбии в Канаде исследовали полторы тысячи семей с полугодовалыми детьми. Выяснив у родителей, как хорошо малыши умеют регулировать эмоции (да-да, разницу в способности управлять эмоциями можно выявить даже в таком нежном возрасте – для этого существуют специальные опросники), исследователи взяли у детей образцы слюны и определили, сколько копий укороченной версии гена SLC6A4 несет каждый ребенок. Параллельно специалисты узнали, нервничала ли мама малыша во время беременности. Выяснилось, что хуже всех справляются с эмоциями мальчики и девочки с двумя "плохими" (короткими) копиями 5-HTTLPR, чьи матери во время беременности беспокоились и испытывали стресс. На втором месте оказались дети нервных мам с одним "плохим" вариантом гена SLC6A4. Если у ребенка обе версии гена серотонинового транспортера были длинными, существенного влияния материнского беспокойства на способность контролировать эмоции ученые не обнаружили [84]. Все бы хорошо, но три года спустя исследователи из нескольких британских университетов попытались повторить эту работу, на этот раз почти на четырех тысячах детей. И не обнаружили корреляции между количеством "плохих" копий 5-HTTLPR и эмоциональной несдержанностью [85].
Тот факт, что два вполне надежных и масштабных исследования прямо противоречат друг другу, скорее всего, означает, что ученые в своих работах упускают другие факторы среды или генотипа, которые могут усиливать или ослаблять влияние материнского беспокойства. Например, какой-то ген, обладатели которого становятся стойкими к неблагоприятному воздействию стресса независимо от того, есть ли у них "кривая" версия серотонинового транспортера. Это простой случай, но вполне может быть, что влияние неизвестного гена пропорционально суммируется с эффектом "неправильных" вариантов SLC6A4. Если у ребенка есть одна короткая копия серотонинового транспортера и такой таинственный ген, он будет хорошо управлять своими эмоциями. При двух копиях "плохой" версии и одной – неизвестного гена будет делать это хуже, а при сочетании двух "плохих" вариантов 5-HTTLPR и двух "правильных" версий еще не открытого гена снова будет отлично контролировать эмоциональные вспышки. Очевидно, что шанс обнаружить такую сложную корреляцию есть, только если точно знать, что искать. И работать с очень большими, даже огромными выборками – только так получится набрать нужное количество всех возможных сочетаний. А если дополнительно влияющих генов не один, а два или три, выявить все возможные комбинации и вовсе нереально.
Для другого "гена безволия", DRD4, "плохие" версии которого нередко встречается у людей с ослабленным самоконтролем, результаты чуть более определенные. DRD4 – один из типов дофаминовых рецепторов, т. е. это белок, который торчит на поверхности клеток и ловит молекулы дофамина. Если рецепторов мало, они слишком сильно или, наоборот, слишком слабо удерживают нейромедиатор, у человека меняется отношение к приятным вещам. В недавнем исследовании авторы проверяли, нет ли связи между пренатальным стрессом, "плохим" вариантом гена дофаминового рецептора DRD4-7R и антисоциальным, чрезмерно агрессивным поведением у подростков. Напомню, агрессия рассматривается как одна из форм недостаточного самоконтроля: агрессивные люди не в силах сдерживать желание ударить или оскорбить кого-то, даже если знают, что вспышка гнева закончится вызовом полиции или увольнением. Распространенный тип агрессивного поведения, когда подросток все время дерзит, спорит по любому поводу, не слушается, легко раздражается и выходит из себя, называют оппозиционным вызывающим расстройством (ОВР)47. И оказалось, что хотя бы отчасти в таком поведении виновата мама – причем виновата неосознанно. Если она сильно нервничала во время беременности, а ребенок несет одну или две копии DRD4-7R, вероятность, что у него разовьется ОВР, выше, чем для детей с нормальными вариантами дофаминового рецептора. Причем две копии DRD4-7R значительно повышают вероятность, что ОВР будет протекать особенно тяжело. У носителей двух копий "хорошего" варианта того же гена, который обозначают DRD4-4R, стресс in utero (т. е. в матке) не увеличивал шансы неприятных последствий для психики. Даже если мама, вынашивая ребенка, постоянно о чем-то беспокоилась, риск развития ОВР для таких детей был таким же, как для малышей со спокойными мамами [86]. Повышенная агрессивность сохраняется у детей с DRD4-7R как минимум до 15 лет [87]. Дальше, вероятно, тоже, но пока ученые не исследовали детей более старшего возраста.
Таким образом, гены ребенка опосредуют материнский стресс, смягчая или усугубляя его. В результате одинаковое по силе воздействие на женщину – скажем, развод во время беременности – может приводить к очень разным физиологическим эффектам и, соответственно, разным последствиям для самоконтроля малыша. Но и это еще не все: как мы уже говорили, реакция матери на одно и то же воздействие тоже во многом определяется генами. Женщина, ГГНС которой "спроектирована" так, что сильнее реагирует на любой стимул, будет в принципе нервничать больше, чем женщина с менее возбудимой ГГНС. А значит, ее ребенок, находясь в матке, получит больше глюкокортикоидов – со всеми вытекающими последствиями. Выше мы уже обсуждали, что "неудачные" варианты гена серотонинового транспортера SLC6A4 заставляют организм излишне остро реагировать на стресс. По сравнению с обладателями нормальных версий гена носители одного или двух коротких вариантов намного сильнее беспокоятся и нервничают из-за одних и тех же событий [88]. В одном из опытов ученые подвергали стрессу беременных крыс, у части которых был "выключен" крысиный аналог SLC6A4, – такие крысы считаются неплохой моделью, чтобы изучать поведение людей, несущих короткие версии SLC6A4. У крысят, рожденных от матерей с неработающим геном серотонинового транспортера, были выраженные сложности с поведением. Потомки крыс с неповрежденным геном вели себя нормально, хотя их матерям точно так же наливали воду в подстилку, пугали запахом лисы, заставляли слушать постоянный громкий шум, не давали двигаться и все время меняли клетки – в общем, создавали тотальный стресс [89].
На людях убедительных экспериментов, которые бы доказывали, что гены матери, опосредующие ее реакцию на стресс, влияют на самоконтроль ребенка, пока не проводилось. Но по отдельности обе половинки этой схемы (1 – определенные гены делают организм более склонным остро реагировать на стресс, и 2 – пренатальный стресс плохо сказывается на силе воли ребенка, особенно если он несет "плохие" варианты некоторых генов) были подтверждены много раз. Так что можно предположить, что такие гены у будущей мамы – возможный фактор риска для силы воли ребенка.
Курение матери в сочетании с "плохими" генами может влиять на самоконтроль
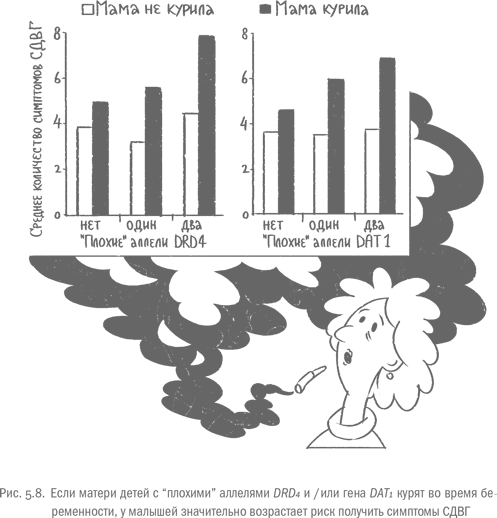
Есть еще один фактор, который не подпадает под строгое определение стресса, но "работает" у беременных похожим образом. Этот фактор – курение. Об опасности сигарет для здоровья младенца написаны тонны литературы, но здесь я хочу рассмотреть лишь конкретное следствие: как курение будущей матери влияет на самоконтроль ребенка, и есть ли гены, которые это влияние могут усилить. Оказывается, привычка будущей мамы выкурить сигаретку-другую и самоконтроль ее ребенка связаны напрямую. Это было показано в большом количестве работ, в которых изучали детей с синдромом дефицита внимания и гиперактивности (СДВГ). Это расстройство – крайний вариант нарушения самоконтроля, который часто встречается у детей. Насколько именно часто, сказать сложно, потому что легкие формы СДВГ могут оставаться недиагностированными: родители просто считают, что у них очень рассеянный и беспокойный ребенок, и не обращаются к специалистам. По статистике, диагноз СДВГ получают от 4 до 12 % детей, и, по разным оценкам, у 10–60 % (!) таких детей почти все симптомы сохраняются во взрослой жизни [90]. Так что неспособность сосредоточиться, побороть желание закурить или съесть шоколадку, вечные опоздания и срывы дедлайнов вполне могут быть проявлениями того самого СДВГ, который не был обнаружен в детстве.
Конечно, для того чтобы всерьез говорить о диагнозе, нужен врач. Но СДВГ – это симптомокомплекс, т. е. диагноз ставится, если набирается нужное количество проявлений. Граница, отделяющая болезнь от не-болезни, проведена условно: какого-то одного аллеля или признака, которые бы однозначно определяли, что у ребенка СДВГ, не существует. Это всегда набор нарушений, и даже если у человека есть только часть симптомов, нельзя исключать, что причины этих проявлений те же, что у людей с "настоящим" СДВГ. Просто у "недобравшего" сработали не все триггеры или есть компенсаторные механизмы, которые не дают в полной мере проявиться симптоматике СДВГ. Поэтому хотя бы отчасти исследования, касающиеся синдрома дефицита внимания и гиперактивности, приложимы к "обычным" проблемам самоконтроля, так как механизмы нарушений у этих двух состояний во многом пересекаются.
Итак, что же обнаружили ученые, которые искали связь между сигаретами и СДВГ? Во-первых, они подтвердили, что курение во время беременности увеличивает риск развития СДВГ. А во-вторых, у детей, которые несли две копии одного из "нехороших" вариантов гена дофаминового рецептора типа 4 – DRD4-7R, симптомы заболевания были заметно более выражены [91]. В другой работе авторы показали, что у обладателей "плохой" версии транспортера дофамина DAT1 (ген SLC6A3), если их матери, будучи беременными, курили, риск развития СДВГ в три раза выше, чем у детей с "хорошим" аллелем, чьи мамы не курят. Для носителей аллеля DRD4-7R риск СДВГ тоже повышен в три раза – при условии, что мать курила во время беременности. Дети курящих мам, в чьих генах есть и "безвольная" версия SLC6A3, и DRD4-7R, рискуют больше всех. Для них вероятность СДВГ по сравнению с неносителями, матери которых не баловались сигаретами, вынашивая ребенка, возрастает аж в девять раз [92]. Если говорить об отдельных нарушениях самоконтроля, которые входят в общий список для диагностики СДВГ, но могут проявляться и сами по себе, то тут картина еще более впечатляющая. Если будущая мама курит, то у ребенка с двумя "плохими" аллелями DRD4-7R в среднем будет восемь таких признаков, а у малыша с теми же аллелями, но некурящей мамой – только пять. Похожая ситуация у детей с двумя "неправильными" версиями SLC6A3 (ген транспортера DAT1): у отпрысков курящих мам – семь признаков, некурящих – четыре.
Исследования СДВГ в перспективе могут помочь в создании терапии этого расстройства, поэтому на такие работы выделяют много денег. Изучение самоконтроля самого по себе для фармакологии не так перспективно, поэтому грантов в этой области значительно меньше. А значит, меньше работ по "чистому" самоконтролю. Но кое-какие изыскания все же проводятся. И они тоже показали, что курение мамы во время беременности заметно повышает вероятность, что у ребенка будут сложности с силой воли [93]. Особенно если у него есть проблемные аллели вроде варианта дофаминового рецептора DRD2/ANKK1 A1 [94]. Более того, на способность малыша контролировать свои порывы влияет даже пассивное курение мамы. Сама беременная может не прикасаться к сигаретам, но если она часто находится в прокуренном помещении или среди курящих, то новорожденный с высокой вероятностью не будет чемпионом силы воли. Причем достоверные отличия сохраняются между детьми пассивных курильщиц и женщин, которые во время беременности избегали сигаретного дыма, как минимум до 15 лет [95]. Наверняка они никуда не исчезают и позже, просто у авторов работы были данные детей только до этого возраста.
Как именно табак влияет на механизмы, определяющие способность к самоконтролю, пока неясно. Известно, что из-за содержащихся в дыме токсинов у ребенка не до конца или не совсем правильно развиваются некоторые отделы мозга: лобные доли детей, чьи матери не бросили вредную привычку во время беременности, меньше, чем у детей некурящих мам [96]. Недоразвитость отдельных частей мозга, например ПФК, и сама по себе фактор риска для самоконтроля. А если к этому добавить вредное действие DRD4-7R, 5-HTTLPR и других полиморфизмов, то риск получить проблемы с силой воли возрастает еще сильнее.
Работ, в которых изучается воздействие на самоконтроль других популярных токсических веществ, а именно алкоголя и наркотиков, почти нет. Причина здесь не в том, что спиртное и наркотики не влияют на силу воли: каждый, кто видел окончательно спившегося алкоголика или сторчавшегося наркомана, знает, что влияют, и еще как. Просто воздействие этих веществ настолько сильно и поражает такое количество функций, что выделять отдельно самоконтроль нет смысла – это все равно что пытаться оценивать, изменяется ли работа отдельных микросхем в телевизоре после того, как его разбили молотком. Большие дозы алкоголя и наркотиков выводят из строя весь мозг сразу, а оценить влияние малых доз очень сложно: здесь вступают в игру индивидуальные отличия и компенсаторные механизмы, так что дозы, опасные для одних детей, на других не окажут катастрофического влияния. Заранее узнать, насколько стоек ребенок к токсинам, пока невозможно, так что лучше не рисковать и хотя бы во время беременности воздерживаться от потенциально вредных воздействий.
Повреждающие факторы – от стресса до никотина – изменяют работу генов, задействуя эпигенетические механизмы
Выше я много раз говорила, что пока ученые не до конца понимают, как именно стресс и другие факторы влияют на силу воли. Достоверно подтвержден один механизм – активация ГГНС, как у плода, если нервничает мама, так и у зрелого организма, если переживает ребенок или взрослый. Но, очевидно, есть и другие механизмы. Так, исследователи почти не сомневаются, что стресс портит силу воли (и не только ее) эмбриона и новорожденного посредством могучего инструмента под названием эпигенетическая – то есть надгеномная – регуляция. Впервые термин предложил британский биолог Конрад Уоддингтон в 1942 году. Ученый работал с мухами и знал, что, если обработать куколок парами эфира, взрослые мухи вырастут уродцами с измененным телом (вместо жужжалец на нем появятся зачатки второй пары крыльев). Чтобы проверить, сохраняется ли это изменение в поколениях, Уоддингтон скрещивал таких мух друг с другом. Потомков "неправильных" насекомых ученый тоже обрабатывал эфиром, затем отбирал потомков с недокрыльями и снова скрещивал их. Уоддингтон повторил эти манипуляции с несколькими поколениями мух, а затем убрал из опыта эфир. К удивлению исследователя, мухи "отращивали" дополнительную пару крыльев даже без обработки токсичными парами. Изменение, которое было вызвано внешним воздействием и, очевидно, не изменяло ДНК (ученый травил эфиром уже вылупившихся куколок, гены которых не были повреждены), каким-то образом проявилось и передалось в череде поколений [97]. Уоддингтон назвал диковинный способ наследования "мягким" – в противовес обычному "жесткому", когда новые признаки сохраняются благодаря изменениям в генах, т. е. мутациям. Термин "эпигенетика" прижился, хотя позже выяснилось, что у мух Уоддингтона проявилось не "классическое" эпигенетическое наследование, о котором мы поговорим ниже.
В 1940-е годы ученые не знали, где именно и как хранится наследственная информация: американцы Альфред Херши и Марта Чейз провели знаменитый эксперимент, в котором было однозначно показано, что носитель такой информации – ДНК, только в 1952 году48. Но уже тогда было ясно, что, воздействуя на взрослый организм или даже на эмбрион, невозможно прицельно изменить этот носитель так, чтобы он передал потомкам новый признак49. После экспериментов Уоддингтона и его последователей выяснилось, к большому огорчению тех, кто любит получать простые ответы на сложные вопросы, что наследование всевозможных характеристик – намного более запутанный и многогранный процесс, чем полагали генетики. Энтузиасты проекта "Геном человека" были уверены: как только ученые получат в свое распоряжение полную последовательность ДНК, они быстро разберутся, как закрепляются и реализуются разные признаки. После расшифровки стало ясно, что быстро разобраться не получится – слишком многого мы пока не понимаем. А тут еще возникла эпигенетика, которая по сложности вполне может соперничать с генетическим наследованием.
Эпигенетические модификации не меняют ДНК, но указывают ферментам, как именно считывать записанную в ней информацию
Эпигенетические механизмы заставляют ферменты по- разному считывать те или иные гены, расставляя на них всевозможные "пометки" – химические модификации. Сегодня ученые знают множество способов такой маркировки: начиная с 1980-х годов ежегодно издаются сотни и тысячи работ по эпигенетике. Лучше всего изучено так называемое метилирование ДНК – навешивание метильных остатков (химическая формула – CH3) на некоторые генетические "буквы". Чаще всего "буквы", на которые ставятся метки, расположены на особых участках в начале генов под названием промоторы. Промотор – это как бы предисловие к гену, в котором сообщается, как именно его следует читать. На промоторы же "садятся" ферменты, расшифровывающие записанную в гене информацию. Обнаружив на промоторе метильные группы, ферменты "понимают" что считывать этот ген не нужно. В итоге внешне он остается не поврежденным, однако на деле не работает. Кстати, многие "мутации безволия", о которых мы говорили выше, находятся как раз в промоторах.