Воля и самоконтроль. Как гены и мозг мешают нам бороться с соблазнами
Еще одна способность, которая страдает, когда организм постоянно находится под воздействием стрессора, – это способность запоминать новую и извлекать из долговременной памяти старую информацию. У крыс, которых ежедневно на два часа бросали в заполненную водой клетку, уже через месяц заметно ухудшалась рабочая память. Как вы помните, для того, чтобы контролировать свои порывы, нужно одновременно удерживать в мыслях довольно много соображений (хотя если ты крыса, то эти соображения не оформляются в слова), а чем меньше объем рабочей памяти, тем сложнее это делать. Когда ученые посмотрели, что творится в головах стрессированных крыс, оказалось, что в их префронтальной коре заметно снизился дофаминовый трафик. Когда крыс мучили водяными клетками всего неделю, количество циркулирующего в ПФК дофамина, наоборот, увеличивалось. То есть острый стресс проявляется в избыточном выбросе нейромедиатора, который снижается, когда стрессовое воздействие исчезает. Если дофаминовый наплыв не проходит долгое время, рецепторы изо всех сил пытаются подстроиться под новые условия: при хроническом стрессе они все время активированы но не справляются с потоком нейромедиатора [47]. Кроме того, у крыс, которых в течение трех недель на три часа в день отсаживали из общего вольера в крошечную клетку, изменялась структура гиппокампа – главного "ответственного" за память. У части нейронов отмирали дендриты. Итог – проблемы с обучением и запоминанием [48].
Способен ли гиппокамп восстанавливать свою структуру после того, как длительный стресс заканчивается, пока неясно. Однако результаты небольшого исследования на людях указывают, что ответ на этот вопрос скорее "нет". Ученые сравнили анатомию мозга женщин, которые постоянно переживают из-за чего-то, с теми, кто считал, что в их жизни все спокойно. И оказалось, что у первых значительно меньше объем гиппокампа и орбитофронтальной коры42 – той самой, которая намертво переплетена с вентромедиальной ПФК, мозговым "фильтром", сдерживающим порывы лимбической системы [49]. Так что вполне вероятно, после десяти лет нелюбимой работы или опостылевшего брака вам будет существенно сложнее одновременно рассматривать много доводов "за" и "против" чего-то. А значит, вы будете чаще совершать поступки, выгодные сейчас, но вредные в будущем – например, смотреть сериалы вместо того, чтобы ходить в спортзал, или все время откладывать занятия английским, хотя он необходим для продвижения по службе.
Наконец, стресс изменяет схему выброса глутамата – основного активатора мозга. Когда организм сталкивается с острым стрессом, количество глутамата в лимбической системе, гиппокампе и ПФК быстро растет – там происходит мощный выброс нейромедиатора. Если нервирующее воздействие долго не исчезает, то, по до конца не ясным причинам, концентрация глутамата в ПФК, наоборот, падает [50].
Итак, жизнь в постоянном напряжении не просто дискомфортна. Она серьезно изменяет работу и даже структуру мозга, и это состояние не лечится популярным народным методом "Отдохни – и все пройдет". Не исключено, что некоторые изменения сохранятся на всю жизнь, и изрядная их часть уменьшает наши возможности контролировать порывы.
Хронический стресс сбивает тонкие настройки регуляции организма
Наш организм – совершенная система, которая замечательно приспосабливается к изменениям окружающей среды. Для того чтобы внезапные перепады внешних параметров не нарушали тонкие функции организма, большинство процессов в наших телах регулируются по принципу отрицательной обратной связи. Если какое-то действие начинает происходить слишком активно, включаются механизмы, которые его приглушают. Эта кнопка безопасности срабатывает и при длительном воздействии стрессовых факторов: когда педаль газа гипоталамо-гипофизарно-надпочечниковой системы (ГГНС) нажата слишком долго, организм пытается снизить вредное воздействие стрессового ответа и уменьшает количество рецепторов к глюкокортикоидам (вырабатываемые корой надпочечников стероидные гормоны, к которым относится и кортизол; активно вовлечены в стрессовый ответ), в том числе в префронтальной коре [51]. Но так как стрессовый фактор не исчезает (скажем, вы продолжаете работать на той же нервной работе или жить с партнером, с которым постоянно ругаетесь), мера, которая призвана спасти участвующие в стрессовом ответе системы от истощения, вызывает разрушительный эффект. Кратковременная активация ГГНС помогает организму собраться, чтобы противостоять повреждающему фактору. Слишком длительная активация разрушает организм, который не может все время работать в экстренном режиме. Но, ослабляя ГГНС, организм лишает себя защиты собственно от стрессового воздействия. Если напряжение не проходит очень долго, механизм регуляции по принципу обратной связи ломается, и тогда стрессовый ответ окончательно выходит из-под контроля. Живя под воздействием хронического стресса, мы попадаем в цугцванг, когда все выходы из ситуации – держать ГГНС активной, выключить ее или отключить обратную связь – плохи. Все, кроме одного: изменить ситуацию и убрать из жизни вредный фактор.
Наш организм эволюционно не приспособлен к длительному стрессу
В этом месте знакомый с основами эволюционной теории читатель может спросить: "Как вышло, что столь разрушительная реакция организма на длительный стресс в принципе сохранилась? Люди с такой непродуктивной физиологией должны были давно вымереть". Возражение логичное, но в данном случае неприменимое. Наш организм отлично приспособлен к ответу на кратковременный стресс, потому что он был обычным делом на протяжении миллионолетней истории наших предков. Нападения тигров и врагов из другого племени, стычки с собственными соплеменниками, голод из-за того, что мужчины не смогли убить мамонта, резкое похолодание, затопление родной пещеры и тому подобные события случались довольно часто. Но каждое из них длилось не очень долго – от нескольких минут до нескольких недель. Наши предки не ездили в метро два раза в день по 40 минут, не изнывали десятилетиями на опостылевшей работе, не терпели ненавистного супруга, "потому что развод травмирует детей". Длительный стресс появился в жизни человека, по меркам эволюции, совсем недавно: каких-нибудь несколько тысяч лет назад. За столь короткий срок вид Homo sapiens не мог успеть перестроить свои физиологические особенности. Кроме того, длительный стресс убивает нас довольно медленно, оставляя возможность размножиться и передать детям "вредные" гены, которые обеспечивают реализацию стрессовых реакций43. Иными словами, даже если наши далекие предки все же страдали от хронического стресса, эволюцию это не интересовало. Логика проста: если организм в состоянии завести и вырастить достаточное количество детей, значит, его физиология достаточно хороша и менять ее не нужно. А невыносимые страдания организма эволюцию не интересуют.
Работ, в которых бы сравнивался базовый уровень кортизола у племен, сохранивших доисторический образ жизни, и современных людей, мне найти не удалось. Но можно предположить, что у наших предков гормона стресса в среднем было меньше, чем у нас. Уровень кортизола подскакивал на охоте или во время драк, но эти события случались не так уж часто. Например, бушмены из пустыни Калахари тратят на интенсивные и потенциально опасные занятия вроде охоты в среднем около четырех часов в день, а остальное время занимаются рутинным трудом по хозяйству или отдыхают. Учитывая, что каменные орудия, с которыми можно охотиться на крупных зверей, Homo habilis изобрели около 3 млн лет назад, а сельское хозяйство, радикально изменившее традиционный уклад жизни, появилось примерно 12 тысяч лет назад, 99,9 % времени существования человечества наши предки жили примерно как калахарские бушмены. А промышленная революция, давшая нам вредные для здоровья заводы, душные офисы и автомобили с пробками, и вовсе случилась 200 лет назад. Поэтому не стоит удивляться, что наш организм так плохо реагирует на длительный стресс.
На самом деле у организма есть способ бороться с хроническим стрессом. Точнее, с одним видом хронического стресса, а именно голоданием. На всем протяжении истории человечества нехватка пищи была обычным делом, и поколение за поколением выживали преимущественно те представители рода Homo, чей организм был лучше приспособлен к длительному недоеданию. Голод – мощный триггер, который запускает стрессовый ответ, в том числе увеличивает концентрацию кортизола. Через несколько дней вынужденной диеты гипоталамус наших предков начинал в больших количествах производить вещество под названием нейропептид Y. Эта коротенькая молекула обладает мощным анксиолитическим, т. е. противострессовым эффектом, но одновременно вызывает чувство голода и снижает активность всех систем организма. То есть нейропептид Y, с одной стороны, затормаживал голодающего пещерного человека, чтобы он перестал бегать и попусту расходовать энергию, но с другой – подстегивал чувство голода, не давая ему забыть, что нужно срочно раздобыть что-нибудь съестное. Крысы, которым вводили нейропептид Y, становились очень спокойными и совсем не нервничали, когда их вынимали из теплых клеток и оставляли на открытом пространстве. Обычно такая манипуляция вызывает у животных настоящую панику [52]. Правда, такие крысы начинали поедать все, что попадалось им на глаза, толстея в два раза за несколько недель [53]. Стремясь уберечь хозяина от будущего голода, нейропептид Y еще и заставляет организм откладывать полученные наконец калории на животе [54].
Стимулом к выбросу нейропептида Y служит длительное повышение концентрации кортизола, причиной чего у обитателей пещер, не в последнюю очередь был голод. Когда наши предки, подстегиваемые нейропептидом Y, находили орехи или ловили какую-нибудь косулю, голод отступал и уровень кортизола падал. У современных людей высокий уровень гормона стресса – едва ли не норма, но причина этого состояния вовсе не в отсутствии еды. Однако воспитанный многолетней нехваткой пищи организм не знает об этом и пытается спасти от стресса офисных сотрудников, выделяя нейропептид Y. Итог: постоянно нервничающие жители мегаполисов все время хотят есть и поглощают чудовищное количество калорий. Расползающаяся талия заставляет их нервничать еще больше, старательный гипоталамус "успокаивает" несчастных нейропептидом Y, есть хочется все сильнее, на очередном ремне кончаются дырки, от расстройства человек идет в кондитерскую – и так до бесконечности. Выход все тот же: избавить себя от постоянного стресса. Любые другие меры вроде спортзала или липосакции способны лишь устранить симптомы, но коварный нейропептид Y по-прежнему будет заставлять вас хотеть есть и страдать.
У людей с "неправильными" вариантами "генов самоконтроля" разрушительные эффекты стресса еще более выражены
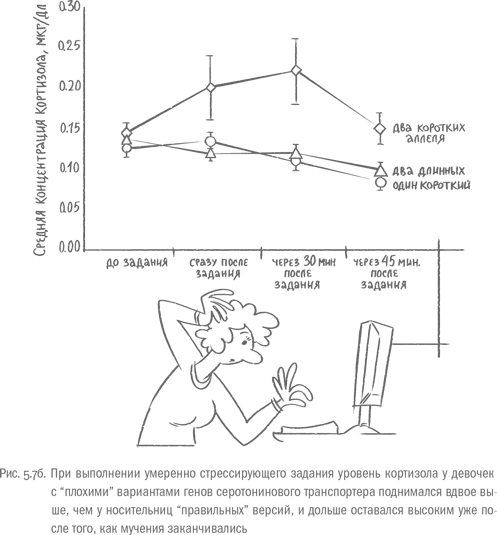
Длительный стресс расшатывает важнейшие системы организма у всех людей. Но один и тот же фактор, скажем, постоянные конфликты на работе, одного человека доведет до больницы за пару месяцев, а другой сможет более или менее нормально функционировать несколько лет. То, насколько выраженной у человека будет реакция на стресс, и, соответственно, как сильно она навредит организму, если затянется, зависит от генов. И оказалось, что на интенсивность стрессового ответа очень мощно влияют варианты "генов самоконтроля", о которых мы говорили в главе 4. Например, небольшой участок под названием 5-HTTLPR, который регулирует активность гена транспортера серотонина – тот самый, что отличается по длине у разных людей. После того как девочки, в ДНК которых было два "плохих" (коротких) варианта этого гена, выполняли умеренно стрессирующее задание в лаборатории44, уровень кортизола у них подскакивал вдвое по сравнению с участницами, несущими длинные варианты. После окончания экзекуции у обладательниц длинных версий 5-HTTLPR уровень кортизола быстрее возвращался к норме, чем у носительниц коротких вариантов [55].
Короткие варианты серотонинового транспортера повышают риск всевозможных хронических болячек у безработных женщин [56]. Длительная безработица – мощный стрессовый фактор, но обладательницы "плохих" версий 5-HTTLPR из-за повышенного уровня кортизола и в целом более сильной реакции на эту, безусловно, нервную ситуацию рискуют довольно быстро обзавестись еще и проблемами со здоровьем. Недомогания разной степени тяжести дополнительно усиливают стресс, и разрушительная спираль раскручивается все быстрее. Еще одно типичное следствие умеренных, но постоянных стрессовых воздействий (т. е. обычной жизни) у носителей коротких версий серотонинового транспортера – депрессия [57]. Люди, у которых есть те или иные проблемы с метаболизмом серотонина, и так больше подвержены этому заболеванию, но хронический стресс служит мощным триггером. Самоконтроль при длительном стрессовом воздействии у носителей двух коротких версий 5-HTTLPR страдает вдвойне: этот генотип сам по себе ослабляет силу воли, а при стрессе наши возможности держать в узде порывы особенно ухудшаются. К тому же в норме серотонин усиливает регуляцию по принципу отрицательной обратной связи при кратковременной активации ГГНС. Поэтому неудивительно, что при длительном стрессе расстройства серотониновой системы дают такой впечатляющий эффект: раскручивание разрушительного стрессового ответа ничем не сдерживается.
Еще один "ген самоконтроля", который делает воздействие хронического стресса более опасным, – это ген моноаминоксидазы А (МАОА), фермента, уничтожающего "лишние" нейромедиаторы класса моноаминов, в том числе дофамин, серотонин и адреналин. Мы обсуждали, что мужчины с малоактивной версией МАОА отличаются повышенной агрессивностью, особенно если в детстве они подвергались физическому или психологическому насилию. Ген МАОА "сидит" на X-хромосоме, поэтому у девочек с дефектной версией есть "страховочный" вариант. Но оказалось, что обладатели малоактивного фермента отличаются от мужчин с нормальной версией не только в ситуациях, провоцирующих агрессию. При длительном стрессе, вызванном, например, уходом за тяжелобольными родственниками, они хуже спят и чаще страдают от хронических болезней и депрессий, которые, к тому же, быстрее развиваются. Даже рак и сердечно-сосудистые проблемы у носителей малоактивной версии MAOA в такой ситуации наблюдаются чаще. При этом уровень кортизола у мужчин – носителей "плохой" версии заметно ниже, чем у обладателей нормального варианта. Кроме того, у них сбит суточный цикл этого гормона.
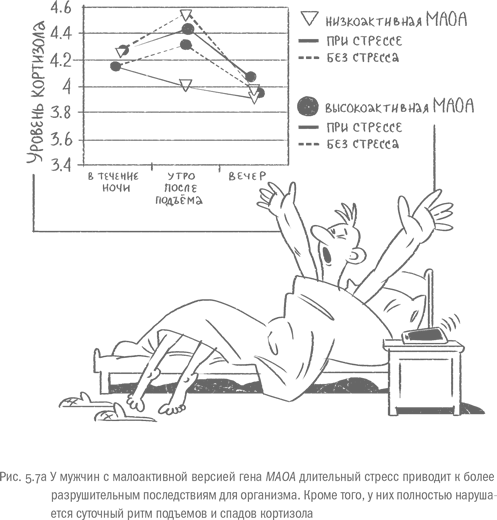
В спокойные времена уровень кортизола выходит на максимум утром, примерно через 30минут после пробуждения. В течение дня и ночи концентрация гормона стресса снижается, чтобы опять подскочить после звонка будильника. Кратковременный стресс вызывает внеплановый скачок кортизола, но затем все возвращается к норме. При длительном стрессе общий уровень кортизола возрастает, однако его динамика остается примерно той же: утреннее повышение, а затем – плавное снижение. У мужчин с малоактивным геном MAOA, которые вынуждены месяцами заботиться о больных родственниках, нет утреннего пика кортизола. Наивысшие показатели по этому гормону наблюдаются ночью, но и они заметно уступают пику носителей "правильной" версии гена. Авторы исследования, которые обнаружили эту аномальную динамику, полагают, что при длительном стрессе ГГНС обладателей малоактивного фермента истощается и выходит из строя. Моноамины регулируют многие параметры ответа на стресс, и при несвоевременной утилизации этих нейромедиаторов начальная встряска ГГНС может оказаться чрезмерной. В первые недели стресса организм носителей малоактивной моноаминоксидазы А реагирует на стресс излишне бурно, и если стрессовое воздействие продолжается, "перегревшаяся" ГГНС отключается. Итог – многочисленные болячки, которые поражают лишенный защиты организм [58].
Другие "гены самоконтроля" тоже могут не лучшим образом проявить себя при стрессе. Например, те из них, что управляют метаболизмом тормозного нейромедиатора ГАМК. В одной из работ было показано, что определенные варианты генов рецептора к ГАМК увеличивают риск наркотической зависимости у людей, которые в детстве пережили крайний вариант стресса – физическое или жестокое психологическое насилие. Другие варианты тех же генов, наоборот, служили защитой: их носители реже становились наркоманами, даже если детьми подверглись насилию [59]. "Неправильные" гены рецепторов к ГАМК – фактор риска для силы воли и у людей, которые выросли без серьезных потрясений [60]. Детская травма срабатывает как триггер, который "срывает чеку" и превращает просто "нехорошие гены" в бомбу, которая разрывает самоконтроль в клочья.
Вычислить все гены, разные варианты которых влияют на интенсивность и длительность стрессового ответа, пока невозможно: для таких исследований нужны гигантские выборки, плюс важно учитывать влияние факторов окружающей среды, многие из которых неизвестны. Но существующие работы показывают, что вклад генотипа и неблагоприятных воздействий среды, особенно в раннем детстве, могут заметно влиять, например, на такой ключевой фактор стрессового ответа, как базовый уровень кортизола [61 и ссылки внутри].