Чому зебри не страждають на виразку
ЧОМУ ІМУНІТЕТ СЛАБНЕ ПІД ЧАС СТРЕСУ?
Дослідження механізму пригнічення імунітету від впливу глюкокортикоїдів та інших гормонів стресу на сьогоднішній день найпопулярніші в галузі клітинної та молекулярної біології, особливо дослідження теми знищення лімфоцитів. Але захоплюючись останніми досягненнями науки, все ж варто поставити запитання, чому взагалі організм дозволяє пригнічення імунної системи під час стресу. Я вже давав відповідь на це питання в Розділі 1, але тепер, коли ми розглядаємо процес пригнічення імунітету внаслідок стресу більш детально, мого попереднього пояснення вже не достатньо. Я говорив, що під час стресу цілком логічно для організму припинити всі довготривалі будівельні проєкти для того, щоб скерувати більше енергії на актуальніші потреби — це стосується й імунної системи, яка, хоч і майстерно виявляє пухлину, що вб’є вас за пів року, або виробляє антитіла, що знадобляться вам за тиждень, у ці секунди критичної ситуації не приносить організму жодної користі. Таке пояснення мало би сенс, якби стрес зупиняв активність імунної системи першої ж миті й організм більше не витрачав жодної енергії на імунну систему аж до завершення стресу. Але насправді так не відбувається. Натомість стрес спричиняє активну розтрату енергії для того, щоб розібрати вже готові складові імунної системи — тканини стискаються, клітини руйнуються. Це не можна пояснити простим припиненням витрат енергії — ваш організм розплачується енергією за демонтаж імунної системи. Отже, на зміну довгостроковій теорії приходить короткострокова.
Чому ж еволюція вигадала для нашого організму таку начебто дурну річ, як-от демонтаж імунної системи під час стресу? Можливо, на це й немає об’єктивної причини. Насправді це не така вже й божевільна відповідь, як вам може здатися. Не все в нашому організмі має пояснення з точки зору еволюційної адаптивності. Можливо, пригнічення імунітету внаслідок стресу є просто побічним продуктом якоїсь іншої адаптивної реакції.
Але це не той випадок. Коли до організму потрапляє інфекція, імунна система виробляє хімічний месенджер інтерлейкін-1, який зокрема стимулює вироблення КРГ гіпоталамусом. Як зазначалось у Розділі 2, КРГ змушує гіпофіз продукувати АКТГ, який зі свого боку спричиняє викид глюкокортикоїдів з надниркової залози. Так відбувається пригнічення імунної системи. Інакше кажучи, за певних обставин імунна система просить організм виробити гормони, які зрештою зупинять роботу імунної системи. Хай з якої причини відбувається пригнічення імунітету, імунна система інколи саме просить про це. Тож, найімовірніше, це стається не випадково[60].
Упродовж останніх років була висловлена не одна ідея, чому ж наш організм активно демонтує імунітет під час стресу за активної участі імунної системи. Деякі з цих ідей здавалися цілком логічними, поки не з’являлася нова інформація про імунітет, що заперечувала якусь із них. Деякі були досить чудернацькими, і я навіть відстоював кілька з них у першому виданні цієї книжки. Але, зрештою, ми дізналися правильну відповідь, яка перевернула цю сферу біології з ніг на голову.
СЮРПРИЗ
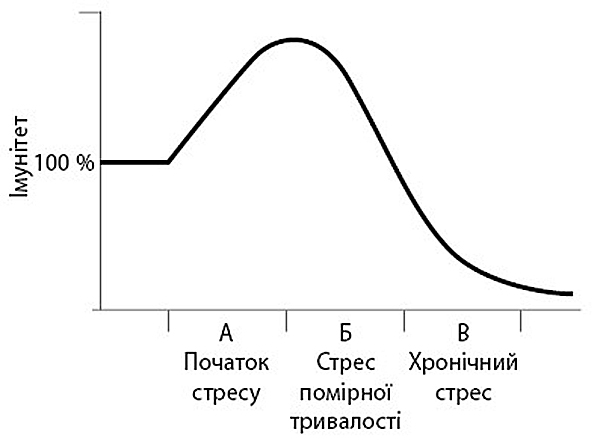
Виявляється, що впродовж перших декількох хвилин (приблизно до 30) після початку дії стресогенного чинника імунітет не пригнічується рівномірно — багато аспектів його роботи
Отже, захисні механізми імунної системи починають працювати з початком впливу різного роду стресогенних чинників на організм. Але ж не забуваймо, що ця палиця має два кінці — стрес може бути як короткочасним, так і хронічним. Після години своєї роботи глюкокортикоїди і симпатична нервова система починають справляти протилежний ефект — пригнічувати імунітет. Якщо до того часу вплив стресогенного чинника на організм завершиться, що ви отримаєте внаслідок пригнічення імунітету? Діяльність імунної системи повернеться до початкового стану, до базового рівня (фаза Б). І лише у разі довготривалого впливу на організм сильного стресогенного чинника або інтенсивної активності глюкокортикоїдів імунна система не тільки не повертається до початкового стану, але й різко падає до рівня, який можна охарактеризувати пригніченням імунітету (фаза В). Якщо розглядати показники діяльності імунної системи, які піддаються кількісному вираженню, то довготривалий вплив на організм сильних стресогенних чинників знижує їх від 40 до 70 відсотків від вихідного значення.
Ідея тимчасової активації імунної системи з початком дії стресогенного чинника є цілком логічною (принаймні настільки ж, як і мудровані теорії про пригнічення імунітету). Так само, як і гіпотеза про те, що за сплеском має відбутися повернення до попереднього рівня. І як часто згадується в цій книжці, якщо організм зазнає впливу стресогенного чинника занадто довго, то за умови адаптивного зниження відповідних показників до норми може статися збій і організм матиме проблеми.
Чому людям знадобилося так багато часу, щоб зрозуміти це? Мабуть, з двох причин. По-перше, тому що більшість методик оцінки діяльності імунної системи тільки нещодавно удосконалилися так, щоб враховувати найменші швидкі зміни для фіксації фази А — швидкого імуностимулюючого імпульсу на початку стресу. Отже, протягом десятиліть люди вважали, що вони вивчають реакцію імунітету на стрес, тоді як насправді вони досліджували відновлення імунітету після стресу. Друга причина полягає в тому, що більшість учених у цій галузі досліджують серйозні стресогенні чинники довготривалої дії або вводять в організм великі дози глюкокортикоїдів упродовж значного часу. Це створює певне викривлення в плануванні і проведенні експериментів через сильний вплив. Якщо нічого не відбудеться, обирається нова сфера досліджень. Якщо щось відбувається і повторюється певну кількість разів і вчений точно впевнений у тому, що це дійсно відбувається, тільки тоді слід задуматися над ретельнішим вивченням. Отже, спочатку вчені досліджували лише ті види стресогенних чинників або моделі впливу глюкокортикоїдів на організм, які призводять до настання фази В, і тільки згодом відкрили тонші нюанси, які допомогли виявити фазу Б.
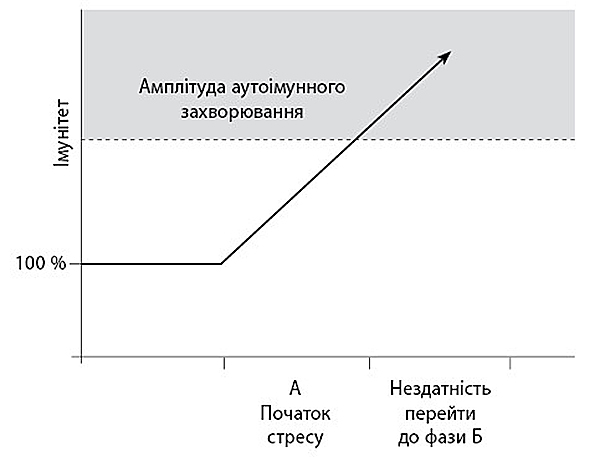
Така переорієнтація відбулася завдяки одному з хресних батьків галузі, Аллану Манку з Дартмутського університету, який спрогнозував більшість з цих нових відкриттів ще в середині 1980-х. Він також зробив власне припущення щодо відповіді на вищезазначене питання, і воно виявилось правильним. Для чого імунітет повинен повернутися на достресовий рівень (фаза Б на графіку)? Чому не дозволити йому працювати в посиленому режимі, який спостерігається в перші пів години, і не користуватися перевагами активної імунної системи весь час? Можна навести таку метафору: чому тоді не тримати армію країни постійно в повній боєготовності? По-перше, занадто великі витрати. Але, що більш важливо, один із солдатів війська, яке постійно перебуває в стані максимальної, підвищеної бойової готовності, може певної миті втратити контроль і ненароком застрелити товариша. Саме це може трапитись і з постійно активною імунною системою — вона може сприйняти частину організму за чужорідного агента і розпочати процес аутоімунного захворювання.
Такі міркування дозволили Манку припустити, що організм, який не проходить фазу Б, тобто не приводить імунну систему назад до нормального рівня діяльності, піддається більшому ризику появи аутоімунного захворювання. Цю ідею було підтверджено в трьох сферах. По-перше, можна штучно зафіксувати рівень глюкокортикоїдів у щурів у низькому базовому діапазоні, а потім піддати їх стресу. Так в організмі тварин наступає фаза А (здебільшого нею керує епінефрин), але рівень глюкокортикоїдів не достатній для повноцінного приходу фази Б. Тобто щури тепер мають підвищений ризик появи аутоімунного захворювання. По-друге, лікарям час від часу доводиться видаляти одну з двох надниркових залоз (джерела глюкокортикоїдів) у пацієнтів, як правило, через появу пухлини. Одразу після операції рівень глюкокортикоїдів у крові знижується вдвічі, доки збережена надниркова залоза не набереться достатньо сил, щоб працювати за двох. Доки в організмі тримається низький рівень глюкокортикоїдів, ризик отримати якусь аутоімунну хворобу або запальний процес підвищується через те, що бракує достатньої кількості глюкокортикоїдів для переходу до фази Б у разі критичної ситуації. І нарешті, якщо дослідити групу щурів або курей з аутоімунними захворюваннями, виявиться, що рівень глюкокортикоїдів у їхньому організмі нижчий за норму або ж їхні імунні та запальні клітини мають знижену сприйнятливість до глюкокортикоїдів. Те саме відбувається і з людьми, які страждають на аутоімунні захворювання — наприклад, ревматоїдний артрит.
Схематичне пояснення того, як нездатність призупинити діяльність імунної системи під час стресу може зумовити появу аутоімунного захворювання.
Отже, на ранньому етапі стресової реакції імунна система не пригнічується, а навпаки активізується, і одне з основних завдань стресової реакції — не допустити появи аутоімунного захворювання через надмірну активність системи.
Отримані висновки змусили переглянути уявлення про діяльність імунної системи. До того ж виявилося, що за довготривалого стресу і зумовленого цим пригнічення імунітету деякі аспекти, які традиційно вважалися показниками пригнічення імунітету, насправді свідчать про його зміцнення.
Це можна довести двома способами. Якщо ввести в організм велику дозу глюкокортикоїдів або піддати його дії сильного стресогенного чинника впродовж багатьох годин поспіль, гормони почнуть масово знищувати лімфоцити. Якщо ж трохи підняти рівень глюкокортикоїдів на короткий час (як відбувається на початку фази Б), гормони знищуватимуть лише конкретний підвид лімфоцитів — ті, що старші і не функціонують. На цьому етапі глюкокортикоїди допомагають
Інший момент стосується переосмислення ідеї, відомої з часів зародження людської цивілізації (або принаймні з досліджень Сельє). Як зазначається, глюкокортикоїди не лише вбивають лімфоцити, але й виводять ті лімфоцити, яким вдалося врятуватися, з кровообігу. Фірдаус Дабар з Університету штату Огайо якось поцікавився: а куди діваються ті імунні клітини, яких виводять з кровообігу? Традиційно вважалося, що всі вони накопичуються в тканинах органів імунної системи (наприклад, у тимусі), виводяться з дії і загалом не приносять організму великої користі. Але дослідження Дабара показали, що не всі лімфоцити виходять з гри. Насправді глюкокортикоїди та епінефрин відводять велику кількість лімфоцитів до конкретних ділянок ураження інфекцією, наприклад, на шкірі. Тож імунні клітини не перестають діяти — їх мобілізують на передові позиції. Як наслідок, рани загоюються швидше.